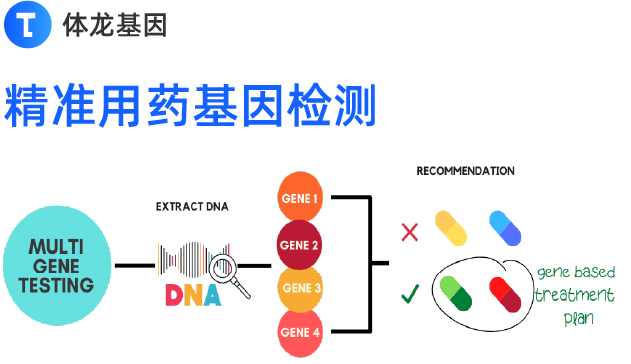
随着分子生物学技术的发展,通过检测样本中病原体核酸可以特异、灵敏地判定标本中是否含有相应的病原体。核酸检测已成为感染性疾病诊断的最主要方法之一,特别是对于在普通实验室难以培养、生长缓慢的病原体以及罕见或新发再现病原体检测等方面均表现出明显优势,如新型冠状病毒感染主要依据核酸检测进行确诊。但常规核酸检测方法存在对人员专业素质要求高、需特殊设备、批测试周期较长等特点,且需要在有资质的基因扩增实验室进行。一方面,在医院门急诊和重症监护室,急性或重症感染的病原学确诊往往滞后,延误治疗且增加院内感染风险。另一方面,疫情流行季大量患者就诊于发热门诊或急诊留观,导致就诊空间紧张、医护人员和个人防护装备严重短缺。因此,有效缩短等待时间和诊疗时间已成为当前感染病学和临床微生物学学科发展的迫切需求。即时检测(pointofcare testing,POCT),又称“床旁检测”“近患检验”,是指在患者附近或其所在地进行的、其结果可能导致患者的处置发生改变的检验[1]。在医疗卫生基础设施建设薄弱的地方,特别是医疗资源匮乏的地方,人们获取高质量和及时的医疗服务是一个挑战。非病原体核酸POCT目前已在我国各级医疗卫生机构广泛应用,主要应用于血糖、心肌标志物等血液化学和免疫学指标,减少对有证检验技术人员的依赖。在传染病筛查领域,相比传统病原学检测方法,POCT在诊断上更加快速和灵敏。POCT作为初级卫生保健机构和公共卫生应急救治中提供给患者的即时检测方法,对传染病防控和医院感染管理,以及提升卫生经济效益有极为重要的作用,有潜力帮助改善公共卫生管理水平。分子生物学技术和POCT的结合,在实现“提取扩增检测”整合一体化的同时,还兼具便携、操作简易、快速、密闭、适用于多种场景的特点,同时能保证高特异性和敏感性[2-3]。POCT核酸检测省去了诸多分区标本处理和大型仪器设备检测的步骤,也简化了数据处理等繁琐过程,可直接快速地得到可靠的结果用于指导患者治疗,从而无论在重大公共卫生事件紧急应对,还是院内感染诊治和管理中,都有为精准治疗和科学防控提供重要技术支撑和保障的前景。【本共识适用于医疗机构临床实验室、独立实验室(第三方检验所)和其他有资质接受临床患者标本的机构。此外,也可供医疗机构科研实验室或高校基础研究实验室参考。】一、病原体核酸即时检测应用场景 医院门急诊和儿科实验室长期以来一直使用POCT检测流感、腹泻和急性咽炎等病原体的抗原或抗体。尽管操作简便,报告快速,使得患者能够得到及时治疗,但这些方法的检测灵敏度和特异性低于核酸检测技术,容易出现漏诊或误诊;此外,在急性呼吸道感染疫情期间,由于在高流行人群中会出现抗原检测假阴性情况,因此应进行病原体核酸检测 [4 – 6].病原体核酸POCT主要应用于发热门诊、急诊、儿科和某些特定病区实验室 。 与普通理化指标POCT检测不同的是,病原体核酸POCT首先需评估生物因子的危害程度,在符合生物安全要求的条件下方可开展工作。根据现阶段技术条件以及未来技术发展趋势, 不同病原体核酸POCT检测技术的主要应用场景有所不同 。推荐建议见表1。 POCT结果属于医学检验报告,因此 必须同样保证其报告准确、及时和信息完整 ,不得出具虚假检验报告。 ★ 尽管POCT的性质决定其可以在非临床检验中心(医学检验科)的实验室开展,鉴于核酸检测的技术特性,仍需具有临床检验资质的检验技术人员(多重核酸检测系统检验人员应具有临床基因扩增上岗证)培训合格后方可进行检测并出具检验报告。也有专家认为:任何病原体核酸POCT均需由同时具有临床检验资质和临床基因扩增上岗证的技术人员完成。从事POCT检验技术人员岗位培训的内容包括:标本采集、仪器操作、校准、保养和故障排除,试剂选择、质量保证、生物安全管理和医疗废物处理等。考核通过后具备POCT检测和报告发放的能力,由所在医院的POCT管理委员会授权其相应工作岗位,并进行管理和督导。除医学检验科外,其他实验室场景一般只对本科室病患进行检测,不向其他科室发放报告。 二、生物安全管理 应在符合国家和地方生物安全法规,以及医院感染管理条例的前提下开展病原体核酸POCT [7-10] 。核酸POCT系统为整合一体化封闭系统,这意味着扩增和检测步骤均发生在封闭空间中,可有效防止生物样本及其遗传物质污染环境。因此核酸POCT的检测环节对检测人员构成的风险较小,但是在标本采集以及样本加入试剂卡/盒环节,操作者会直接接触患者和样本,仍存在病原体暴露风险。 ★ 除严格按照产品说明书推荐的方法操作患者标本,以降低气溶胶的形成、溢出和暴露的风险外,检测区域应至少具备生物安全柜和高压灭菌器等生物安全二级实验室必需设备,保证有传染风险的标本前处理 (例如痰液标本的液化处理、标本的分装等) 的生物安全。 发热门诊应当满足“ 三区两通道” 设置要求 。 清洁区主要包括医护休息区,应当有独立的出入口;缓冲区主要包括污染防护用品的脱卸区,可设置消毒物资储备库房;污染区主要包括诊室、病房、实验室、处置间等医疗功能区,医疗功能区应当充分利用信息化手段和自助便捷服务技术,实现患者自助服务,减少诊疗环节交叉感染的风险。病原体核酸POCT应在医疗功能区的实验室内开展。 检测区域应保持清洁有序,以防止交叉污染 。 物表和地面应每天消毒。当发生溢出或存在可见污染后应立即消毒。检测人员需按照生物安全实验室的防护要求正确穿戴个人防护用品。此外,必须根据产品说明书储存和处理检测试剂。 疑似感染病原体样本的保存、使用以及销毁,应严格按照实验室生物安全操作,实验室排放废气、废水、废弃物处置和消毒灭菌等规章制度,监督核查等安全管理措施与当前感染性病原体基因扩增检验实验室要求一致。 三、标本采集和预处理 病原体核酸POCT的标本采集以及预处理,涉患者、采集人员、检测人员等,其中一个或多个环节处理不当都可能导致分析前标本质量不合格,最终导致检验结果错误。临床常用标本类型及其检验目的推荐见表2。 (一)采样容器及保存液的选择 病原体核酸POCT设备和配套试剂都必须获得国家药品监督管理局批准后方可应用于临床 。 如使用一步法核酸提取,标本采样管中某些保存液成分会影响提取和扩增效率,导致检测灵敏度下降。因此应使用试剂厂家配套的采样容器及保存液进行标本采集。配套的采样容器和检测系统在临床使用之前应进行性能验证。 不推荐使用非配套采样器械 。 特殊情况下如需使用非厂家检测试剂配套的标本采样容器及保存液,需在标本采集前对采样容器及保存液进行性能确认。 (二)标本的采集及预处理 病原体核酸POCT检测的标本类型主要有:咽拭子、鼻拭子、鼻咽拭子、血液、宫颈标本、痰液、尿液、粪便、脑脊液、穿刺液、组织等,各类标本采集方法与常规核酸检测要求一致。 标本采集方法和标本类型的选择、标本的稳定性、运输温度和时间、接收标准、保存条件等应严格遵循产品说明书规定。 标本采集后按照操作说明书检测,痰液、粪便、组织等标本的液化操作需遵照厂家说明书规定,需要特别注意标本上样量不宜过多,避免杂质干扰核酸检测效率。 四、检验程序性能验证 在常规应用前,应由实验室对核酸POCT检测系统进行独立的性能验证,以证实检测程序性能与其所声明性能指标相符 [11] 。任何严重影响检验程序分析性能的情况发生后,应在检验程序重新启用前对受影响的性能进行验证。 病原体核酸POCT主要包括定性和定量检测项目 [12] ,不同项目性能验证参数有所侧重。定性检测项目需验证的性能指标至少包括符合率、精密度(重复性和再现性)和检出限等 [13-14] 。定量检测项目需验证的性能指标至少包括正确度、精密度、线性区间、定量限等 [15] 。对于多重病原体核酸检测,宜尽量覆盖常见病原体种类及基因型。 (一)定性项目的性能验证 01 符合率: 选取阴性样本至少5份,阳性样本(应包含弱阳性样本)一般不少于10份。若无法获得足量阳性样本,可使用人工制备模拟样本;若弱阳性样本不好获取,可用适当稀释阳性样本获得类似效果。阴性样本中应包含与检测对象核酸序列具有同源性、易引起相同或相似临床症状的样本。按照检测程序进行检测,将检测结果与已知检测结果进行比对,计算符合率。符合率≥90%为验证通过。 02 精密度(重复性和再现性): 新鲜或冻存的阴性和弱阳性样本各1份。若无法获得足量临床阳性样本,可适当稀释阳性样本或使用人工制备模拟样本。按照检测程序每天检测3次,连续检测3d(若多人操作应更换操作人员);对于多通道POCT设备,每个检测通道至少检测一次。阴性和弱阳性样本检测结果应完全一致。 03 检出限: 将一份定值标准物质(如国际参考品、国家参考品、厂家参考品等)梯度稀释至厂家声明的检出限浓度,可重复测定5次或在不同批内对该浓度样本进行20次重复测定(如测定5d,每天测定4份样本)。如果是5次重复检测,必须100%检出靶基因;如果是20次检测,必须检出至少18次靶基因。 (二)定量项目的性能验证 01 正确度: 一种方法是采用标准物质材料(如有证标准物质、正确度控制品、正确度验证室间质评样本等),根据测量区间选用至少2个浓度水平的标准物质样本。对每个浓度水平的标准物质样本分别重复测量3次,比较均值与标定浓度值,计算偏倚。另一种方法是采用临床诊断明确的患者样本,收集临床样本至少20份,浓度尽量涵盖线性范围。收集后的样本可在同一天检测,也可在1周内检测完成。待实验全部结束后,比较检测结果和与原检测结果,计算偏倚。要求至少80%的样本结果偏倚<±7.5%。 02 精密度: 可采用新鲜或冻存的临床样本。当样本中待测物不稳定或样本不易得到时,也可考虑使用基质与实际待检样本相似的样本,如质控品。应至少评估2个水平样本的不精密度(变异系数)。所选样本的被测物水平应在测量区间内,适宜时,至少有1个样本的被测物水平在医学决定水平。每天每个样本重复检测3~5次,连续检测5d。待实验全部结束后,对数据进行统计分析,计算批内精密度和批间精密度,与厂商说明书上的精密度进行比较,判断结果是否接受。 03 线性区间 (厂商说明书提供该性能指标时):选取1份结果接近线性范围上限的临床样本,用正常人阴性标本按10倍倍比稀释至5~7个浓度水平,应覆盖定量限(低限和高限)。同一批次内完成所有样本检测,每个浓度样本至少检测3次。分别计算每个样本检测结果的均值,剔除离群值。以稀释计算值作为理论值,各稀释样本的实测值与理论值进行回归分析,计算回归方程,符合厂商说明书中声明的线性要求为性能验证可接受。 04 定量限: 将1份已知定值的标准物质,稀释到说明书声明的检测下限,重复测量20次。待实验全部结束后,将每次检测结果与参考值(换算为对数值)进行比较,要求20次检测中≥18个检测结果与参考值之间的偏倚小于±7.5%。 五、质量保证措施 实验室应建立并实施涉及检测全过程的标准操作程序 [16] ,包括但不限于标本采集、运送、保存,标本接收和预处理、检测操作和复检流程、结果报告和解释、仪器设备维护、性能验证、室内质量控制和室间质评等,有条件的实验室可建立个体化质量控制计划 [17-18] 。实验室使用多台POCT仪器时,在常规运行中,要遵循医院POCT管理文件规定进行定期仪器间比对。 (一)室内质量控制 实验室应进行室内质量控制,以监控检测过程的稳定性。应制定室内质量控制程序,程序中应有针对核酸检测中防污染的具体措施。 POCT检测通常 每个样本都包含一个内部对照(内标),而外部质控品(应包括阳性和阴性)作为单独的样本运行 。内标在控表明正确提取了患者样本,这是获得正确结果的必要步骤。外部质控品则评估检测系统是否提供正确结果。完整的室内质控程序可以控制检测过程、评价检测系统性能,提供质量保证。 室内质控品应 设置阴性质控品(监测污染)和弱阳性质控品(防止假阴性) 。首次使用时,应先检测弱阳性质控品和阴性质控品,质控合格后,开始临床样本检测。之后宜每隔24h或者50份样本(根据工作场所标本量情况设定),再次检测弱阳性质控品。对于多重核酸检测系统,建议在一个批次试剂检测周期内尽可能覆盖常见病原体种类及型别。定性检测项目的质控数据判断需要符合预期阴阳性结果;定量检测项目弱阳性质控结果建议采用Westgard多规则进行判定。质控结果在控才能发出报告。应制定程序对失控进行分析并采取相应措施,应检查失控对之前患者样本检测结果的影响。 (二)室间质量评价 实验室应参加室间质量评价活动,以监控检测过程的准确性 [19-20] 。应由从事POCT核酸检测的人员使用相同检测系统进行室间质评样本的检测,应有禁止与其他实验室核对上报室间质评结果的规定。实验室对不合格的室间质评结果应进行分析并采取纠正措施,并记录。对暂无室间质评的POCT检测项目,应至少每年2次通过与其他实验室比对的方式,判定检测结果的可接受性。 六、结果分析和报告 实验室应根据试剂说明书进行结果分析和解释。尽管POCT设备会提供明确的阳性、阴性或无效结果,实验室仍需结合后台数据(如熔峰图、扩增曲线图等)进行综合判断。 当POCT系统运行良好、检测结果后台数据(包括内参以及待检病原)无误、室内质控在控时,即是有效结果,可按设备提供的阳性或阴性结果进行报告 。 ★ 部分POCT试剂会产生高致病性病原微生物阳性结果(如霍乱弧菌、新型冠状病毒、结核分枝杆菌、百日咳鲍特菌等),实验室应在核查后台数据后(必要时需要进行复检)第一时间将结果报告送检医生,并按规定执行危急值报告和传染病报告制度。在重大传染病管控中,应遵循国家法律法规和管理规范进行报告。如新型冠状病毒核酸快速检测结果阳性时,应使用另外一到两种更为灵敏或扩增不同区域的非快速核酸检测试剂对原始样本进行复检,复核阳性方可报告结果。此外,部分POCT试剂会产生耐药基因阳性结果(如耐甲氧西林金黄色葡萄球菌、耐碳青霉烯类肠杆菌、利福平耐药等),或者高毒性菌株或毒株(如艰难梭菌高毒性027 菌株等),实验室需要结合相应病原的鉴定结果对耐药基因进行判读,并对耐药基因结果进行相应备注。必要时复查,并与中心实验室核酸检测和微生物培养药敏结果核对 [21-22] 。 POCT结果报告单上须醒目注明“POCT及检测方法”字样,并注明所用POCT设备和试剂名称。发布报告时应将检查结果录入实验室信息系统保存备份以便查询,并与医院信息系统相连接。 ★ 除此之外,结果出具报告单也需要注意以下情况。 01 报告形式: 由于POCT所检测的病原体受到种类限定,因此报告单上应明确标明所检测的所有病原体,并注明某种病原检测阳性或上述病原检测阴性,而不能简单描述为病毒阴性、细菌阴性等。 02 报告注释: 由于核酸检测通常无法区分病原体有活力和无活力、或定植和活动性感染的特性,因此其阳性结果也仅表明在当前样本中某种病原DNA或RNA检测阳性,不代表一定由该病原引起的感染;反之,由于POCT通常基于特异性引物靶向某种病原微生物进行检测,当病原的该区域序列发生突变时,可能会出现由于缺乏对该序列的检测而导致假阴性,不代表一定不存在该病原引起的感染。因此建议在报告单上进行备注说明,临床医生也需结合临床实际情况和其他检测结果进行综合判断。 03 当出现以下情况时,需要进行重新检测: (1)质控未通过,结果显示为无效时;(2)后台数据与POCT结果不相符时(例如后台数据出现明显扩增峰,但由于阈值或灰区问题导致POCT报告阴性结果);(3)与常规结果不符(尤其针对强传染性病原阳性结果)、临床医生认为有必要重新检测时。当重新检测结果仍然出现相同情况时,应当与临床医生充分沟通现有检测结果和原因,并考虑是否重新采集样本再检测。七、局限性 01 检测风险: 病原体核酸POCT检测灵敏度比免疫POCT高,加上非专职核酸检测人员的使用会带来检测失败和环境交叉污染的风险。例如,在接种流感疫苗、新型冠状病毒疫苗的诊室或公共场所中,受污染的仪器会产生误报。鉴于核酸POCT操作的简便性, 应该严格遵循厂家试剂盒操作规程,加强对操作人员检验知识和技能的培训 ,使污染机会和人为错误最小化。 02 信息录入: 尽管POCT仪器提供明确的阳性、阴性或无效结果,但该平台通常不与实验室信息系统连接,这意味着必须手动输入结果,会出现转录或其他数据输入的人为错误风险。 03 试剂成本: 目前病原体核酸POCT试剂比常规实时荧光PCR检测和基于抗原的检测更为昂贵。虽然其比POCT抗原检测具有更高的灵敏度和特异性,但是在经济欠发达地区,不能承担分子诊断的高额成本时仍需考虑抗原抗体快速筛查。 04 检测通量: 尽管核酸POCT仪器通常很小巧、便携,但通常平台检测通量较低,甚至部分仪器每次只能运行1~2个样本。在大型医院的发热门诊、急诊科或紧急护理诊所,往往需要多台仪器才能有效满足相应病原体检测通量需求。 总体上,病原体核酸POCT在感染病和传染病的诊治及管理中逐步进入常态化运行,并显示出其独有的优势。 无论是在综合性医院实验室还是在发热门诊,都可大大减轻集中送样所带来的压力和挑战。 实现POCT管理的规范化是一项惠及医患双方的迫切任务,把POCT纳入整个实验检测系统中是非常有必要的,通过系统的质量控制和质量保证措施,其结果可信度会更高。 病原体核酸POCT在不断完善质量控制的前提下,将继续带动临床需求和拓宽应用场景,势必将在提升国家医疗质量安全、公共卫生紧急应对、规范抗微生物药物合理使用以及建立分级诊疗、远程医疗和移动医疗模式下的感染病诊治路径等方面提供有力支持。【参考文献】[1] International Organization for Standardization. ISO 22870: 2016 Point‑of‑care testing (POCT)‑requirements for quality and competence[EB/OL]. [2021‑07‑01]. https: //www.iso.org/standard/71119.html. [2] Larkin PMK, Garner OB. Molecular point‑of‑care testing in clinical laboratories. Clinical Laboratory News. 2020. https://www. aacc. org/cln/articles/2020/july/ molecular‑point‑of‑care‑testing‑in‑clinical‑laboratories.[3] Kuupiel D, Bawontuo V, Mashamba‑Thompson TP. Improving the accessibility and efficiency of point‑of‑care diagnostics services in low‑and middle‑income countries: lean and agile supply chain management[J]. Diagnostics (Basel), 2017, 7(4).DOI: 10.3390/diagnostics7040058. [4] Harris J, AbdelWareth LO, Lari S, et al. Setting up a point‑of‑care testing service in a greenfield, quaternary hospital: an implementation review[J]. Arch Pathol Lab Med, 2018, 142(10): 1223‑1232. DOI: 10.5858/ arpa.2017‑0507‑RA. [5] Nichols JH, Alter D, Chen Y, et al. AACC Guidance document on management of point‑of‑care testing[J]. J Appl Lab Med, 2020, 5(4): 762‑787. DOI: 10.1093/jalm/ jfaa059.[6] Patel K, Suh‑Lailam BB. Implementation of point‑of‑care testing in a pediatric healthcare setting[J]. Crit Rev Clin Lab Sci, 2019, 56(4): 239‑246. DOI: 10.1080/10408363. 2019.1590306. [7] 中 华 人 民 共 和 国 国 家 卫 生 和 计 划 生 育 委 员 会 . WS233‑2017中华人民共和国卫生行业标准病原微生物实 验室生物安全通用准则[S].2017‑7‑24. [8] 中华人民共和国国务院 . 中华人民共和国生物安全法 [S].2020‑10‑17. [9] 中华人民共和国国务院. 病原微生物实验室生物安全管理 条例[S].2004‑11‑12. [10] 中 华 人 民 共 和 国 国 务 院 . 医 疗 废 物 管 理 条 例 [S]. 2003‑06‑16. [11] Verbakel JY, Matheeussen V, Loens K, et al. Performance and ease of use of a molecular point‑of‑care test for influenza A/B and RSV in patients presenting to primary care[J]. Eur J Clin Microbiol Infect Dis, 2020, 39(8):1453‑1460. DOI: 10.1007/s10096‑020‑03860‑5. [12] Clinical and Laboratory Standards Institute. MM 17Validation and verification of multiplex nucleic acid assays[S]2nd ed. Wayne, PA:CLSI, 2018. [13] Wang X, Yao H, Xu X, et al. Limits of detection of 6 approved RT‑PCR kits for the novel SARS‑Coronavirus‑2 (SARS‑CoV‑2)[J]. Clin Chem, 2020, 66(7):977‑979. DOI: 10. 1093/clinchem/hvaa099. [14] 中国合格评定国家认可委员会. 分子诊断检验程序性能验 证指南[EB/OL]. [2019‑4‑15]. CNAS‑GL039.https://www. cnas. org. cn/images/rkgf/sysrk/rkzn/2019/04/04/ EE941BDABEA79C7D6D9128A28852297C.pdf. [15] 中国合格评定国家认可委员会. 临床化学定量检验程序性 能 验 证 指 南 [EB/OL]. [2019‑2‑15]. CNAS‑GL037. https:// www.cnas.org.cn/images/rkgf/sysrk/rkzn/2019/04/04/ B389775AC4A19CF5EDF3038B4A04CF62.pdf. [16] James HN. Risk management for point‑of‑care testing[J]. EJIFCC, 2014, 25(2):154‑161. [17] Clinical and Laboratory Standards Institute. POCT15Point‑of‑care testing for infectious diseases[S]. Wayne, PA:CLSI, 2020.[18] U. S. Department of Health and Human Services. Individualized quality control plan: developing an IQCP a step‑by‑step guide. 2016. https://www. cdc. gov/ labquality/iqcp.html. [19] Wang Z, Chen Y, Yang J, et al. External quality assessment for molecular detection of severe acute respiratory syndrome coronavirus 2 (SARS‑CoV‑2) in clinical laboratories[J]. J Mol Diagn, 2021, 23(1): 19‑28. DOI: 10.1016/j.jmoldx.2020.10.008. [20] 王雪亮, 徐幸, 朱凯, 等 . 新型冠状病毒核酸检测室间质量 评 价 分 析 [J]. 中 华 检 验 医 学 杂 志 , 2020, 43 (11): 1100‑1105. DOI: 10.3760/cma. j. cn114452‑ 20200324‑ 00292. [21] Wen D, Yang S, Li G, et al. Sample‑to‑answer and routine real‑time RT‑PCR: a comparison of different platforms for SARS‑CoV‑2 detection[J]. J Mol Diagn, 2021, 23(6): 665‑670. DOI: 10.1016/j.jmoldx.2021.02.010. [22] 莫茜, 秦炜, 傅启华, 等 . 正确认识新型冠状病毒核酸检测 的影响因素[J]. 中华检验医学杂志, 2020, 43(3): 213‑216. DOI: 10.3760/cma.j.issn.1009‑9158.2020.03.003. (责任编辑:dawenwu)